食品添加物の指定、使用基準の改正に関する食品衛生調査会、毒性部会及び添加物部会合同部会報告について - 別添1 キシリトールの指定について
別添1
キシリトールの指定について
1.品目名:キシリトール(別名 キシリット)(Xylitol)
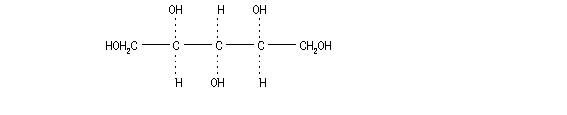
2.構造式:
3.用途:甘味料
4.起源
キシリトールは、プラム、イチゴ、カリフラワー等に含まれている糖アルコールの一つで、1891年、ドイツのEmil Fischerらによって発見され、工業的には1960年頃植物から得られるキシロースを原料として、水素添加により製造することが可能となり、食品添加物の一つである甘味料として使用されるようになったと報告されている。
キシリトールは、現在、米国、カナダ、EU諸国など38カ国において、添加物としての使用が認められている。また、FAO/WHO合同食品添加物専門家会議(JECFA)では、1983年、ADI(一日摂取許容量)は特定せずと評価されている。さらに、1996年のJECFAにおいて、再評価されたが、1983年の評価に同じとされている。
5.有効性
キシリトールはショ糖(砂糖)と同程度の甘味度を持つが、ショ糖と異なり血中のグルコース濃度にはほとんど影響を与えないことが示されている。また、水に極めて溶けやすく、120℃でもカラメル化せず、通常の加工条件下においても化学的、物理的に安定であり、キシリトールを使用した食品はショ糖を使用した食品に比べ水分活性1)が低いことが示されている。
上記を含め、別紙1に示した試験成績が提出されている。
6.安全性
(1)毒性
①反復投与/発がん性試験
CFLPマウスを用いた混餌(2、10、20%)投与による102~106週間の反復投与試験において、10%以上の投与群の雄で体重増加抑制、膀胱結石の発生率の増加、膀胱移行上皮細胞の過形成及び異形成の増加が認められる。これらの変化は、高濃度のキシリトール投与により、栄養障害を起こしたこと、シュウ酸及びカルシウムの排泄が増加したことなどによるものと考えられる。また、膀胱結石の増加等は雄のみに見られており、ヒトにおいてキシリトールの摂取(30~100g/人)は尿中のシュウ酸及びカルシウムの排泄を増加させないとJECFAは報告している。発がん性は認められない。なお、20%投与群のキシリトール摂取量は17.0g/kg体重/日である。
SDラットを用いた混餌(2、5、10、20%)投与による98~107週間の反復投与試験において、20%投与群で盲腸の膨満、副腎髄質の褐色細胞腫の増加が、5%以上の投与群で体重増加抑制、副腎髄質の過形成の増加が認められる。盲腸の膨満は、糖アルコール等吸収の緩やかな物質を高濃度投与した際にしばしば見られる所見であり、20%投与群においてのみ見られている。副腎髄質における褐色細胞腫及び過形成の増加は、ラット特有のポリオール類への反応の結果であり、高濃度のキシリトール投与による栄養成分のアンバランス等によるものと報告されている。なお、20%投与群のキシリトール摂取量は7.4g/kg 体重/日である。
ビーグル犬を用いた混餌(2、5、10、20%)投与による104週間の反復投与試験において、20%投与群で肝比重量の増加が、10%以上の投与群でGPT等の血清酵素値の上昇、門脈周辺の肝細胞質の淡明化が認められる。肝比重量の増加、血清酵素値の上昇及び門脈周辺の肝細胞質の淡明化は、高濃度のキシリトール投与により、インスリン分泌が促進され、グリコーゲンが生成し、それが肝臓に蓄積したことなどによるものであると考えられる。このような変化は、イヌ以外の動物種では見られていないと米国食品医薬品局は報告している。なお、20%投与群のキシリトール摂取量は5.5g/kg体重/日である。
なお、単回投与試験における毒性も極めて低い。
②繁殖試験
SDラットを用いた混餌(2、5、10、20%)投与による3世代繁殖試験において、20%投与群で体重増加抑制が、5%以上の投与群で盲腸の膨満が、20%投与群のF3子動物で体重増加抑制、脳・心臓等の臓器重量の低下が認められる。盲腸の膨満は、上記の反復投与試験でも見られているものであり、臓器重量の低下は、体重増加抑制の影響によるものと考えられる。
③催奇形性試験
CFYラットを用いた混餌(2、5、10、20%)投与による催奇形性試験において、検体投与に起因した影響は認められない。催奇形性は認められない。
Yellow-Silverウサギを用いた混餌(2、5、10、20%)投与による催奇形性試験において、20%投与群の母動物で体重増加抑制が認められるが、高濃度のキシリトール投与による栄養障害を起こしたものと考えられる。催奇形性は認められない。
④変異原性試験
細菌を用いた復帰変異試験、マウスを用いた宿主経由復帰変異試験、Rec-assay試験、ヒト培養リンパ球を用いた染色体異常試験、ヒト線維芽細胞を用いた姉妹染色分体交換試験及びin vitro小核試験、カイコを用いた特定座位試験、並びにマウスを用いた小核試験の結果は、いずれも陰性と認められる。なお、チャイニーズハムスターCHL培養細胞を用いた染色体異常試験の結果は陽性と認められるが、著しく高濃度での結果であり、上記の他の試験成績等から生体内における変異原性は有しないものと考えられる。
⑤その他
上記を含め、別紙1に示した試験成績が提出されている。
(2)体内動態
キシリトールは、ヒトにおいてグルコースに比べゆっくりと腸から吸収され、その約80%は肝臓で代謝される。ヒトに1回40gのキシリトールを経口投与した場合、投与後20時間までに、尿中へ未変化体として投与量の0.3~3%が排泄されるが、糞便中への排泄はごくわずかである。
ヒトに吸収されたキシリトールは、キシリトールデヒドロゲナーゼによってD-キシルロースに変換され、ペントースリン酸回路等により二酸化炭素と水に代謝される。
上記を含め、別紙1に示した試験成績が提出されている。
(3)一日摂取量の推計
キシリトールは菓子類、ジャム類等に使用されると考えられるが、その甘味度はショ糖と同程度であり、菓子類、ジャム類に使用されているショ糖がすべてキシリトールで代替されることは一般に考えられないが、仮にすべて代替されるとした場合、平成4年の精糖工業会の統計に基づき試算すると、平均一日一人あたり摂取量は15.67g/日、体重50kgとすると313mg/kg体重/日である。なお、同種の糖アルコールであるソルビトールの一日摂取量は、厚生省のマーケットバスケット調査によると平均一日一人当たり1,172.1mg/日と報告されており、体重50kgとすると、23.4mg/kg体重/日と報告されている。
(4)ADIの設定
以上の試験結果及び一日摂取量の推計から、考えられる毒性レベルよりその摂取量が十分に低いことが予想されるが、このような場合、JECFAにおいては、ADIを特定する必要がないという考え方に立っており、本部会としても、キシリトールについてADIは特定する必要がないと考える。
7.使用基準
ADIは特定する必要がないと考えられることから、使用基準の設定は要しないと考える。
8.成分規格
成分規格については、別紙2のとおり設定することが適当であると考える。また、本成分規格の設定にあたり、別紙3のとおり一般試験法「赤外吸収スペクトル測定法」を改正することが適当であると考える。なお、参考までにJECFAにおいて設定されている規格等との比較表を別紙4に示す。
注:1)水分活性とは、食品中で微生物が利用しうる水分、すなわち食品中の遊離水分の含有量を表す尺度である。